由维尔纽斯大学生命科学中心(VU LSC)的Virginijus Šikšnys教授领导的团队与哥本哈根大学诺和诺德基金会蛋白质研究中心(CPR)的Guillermo Montoya教授合作,使用冷冻电子显微镜确定了TnpB的结构。
文章“TnpB结构揭示Cas12核酸酶家族的最小功能核心”发表在《自然》杂志上。
CRISPR-Cas核酸酶,如Cas9或Cas12,也被称为基因剪刀,已经彻底改变了基因组编辑领域。它们能够精确编辑基因组并纠正致病突变。然而,Cas9或Cas12的大小限制了它们使用腺相关病毒(AAV)递送到靶细胞,这些病毒已经用于基因治疗。
在他们之前的Nature论文中,VU LSC科学家报告发现了一类名为TnpBs的新型可编程核酸酶,它与称为转座子的移动遗传元件有关。他们证明TnpB是可用于高效基因编辑的最小可编程核酸酶;然而,其结构组织和机制仍然未知。
“刚刚发表的新《自然》论文是持续和长期努力的结果,展示了立陶宛科学家在生命科学领域的潜力以及他们成为该领域领导者的能力。这项研究揭示了TnpB基因剪刀的结构和机制,这为进一步靶向工程TnpB复合物将其转化为治疗遗传疾病的治疗工具奠定了基础,“V. Šikšnys教授说。
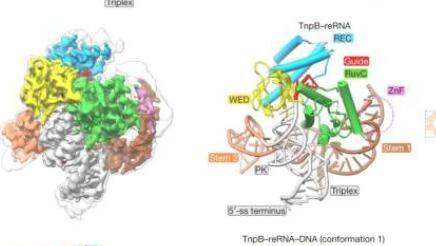
在目前的研究中,科学家使用冷冻电子显微镜(cryo-EM)来确定最小的可编程核酸内切酶TnpB的三元结构,这与生化研究一起解释了TnpB基因剪刀如何精确识别和切割DNA靶标。
结构研究表明,与TnpB蛋白相关的长RNA分子形成复杂的三维结构,不仅有助于识别DNA靶标,还可以控制TnpB的DNA切割活性。结构比较和生物信息学分析表明,TnpB是Cas12核酸酶家族的前体,并形成Cas12结构功能核心。
正如文章作者之一Giedrius Sasnauskas博士所指出的那样,这项研究的成功是由几个因素决定的。“首先,相关的研究对象以及VU LSC生物化学家,分子生物学家,生物信息学家以及哥本哈根大学NNF-CPR的同事的合作。但最重要的是,我们能够使用VU LSC提供的冷冻电子显微镜在立陶宛进行这项研究,“研究人员说。
