小胶质细胞是保护哺乳动物大脑的原代免疫细胞,部分通过吞噬或“吞噬”病原体和有毒碎片。最近的遗传研究一直强调小胶质细胞在阿尔茨海默病(AD)和其他神经退行性疾病发展中的作用,表明它们可以异常地开始吞噬突触,神经元之间的关键连接。
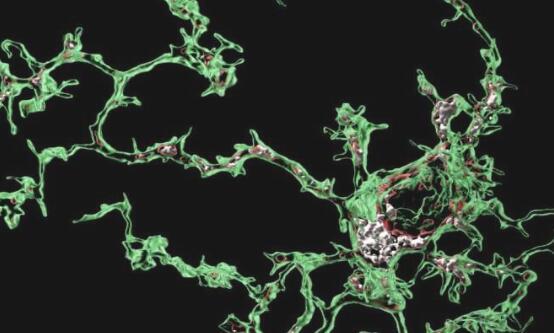
现在,伦敦大学学院(UCL)英国痴呆症研究所的研究人员进行了一项研究,旨在更好地了解小胶质细胞增加患AD风险的吞噬过程。
“当大脑发育时,需要移除小胶质细胞吞噬突触才能正确连接大脑,”该研究的小组负责人和通讯作者Soyon Hong博士告诉Medical Xpress。“然而,当大脑患有疾病或在衰老过程中,小胶质细胞的这种关键功能可能会被重新激活,导致异常吞噬和突触丧失。我们是最早证明小胶质细胞在模仿AD某些方面的小鼠模型中以区域特异性方式暴饮暴食突触的团队之一。这是相关的,因为突触缺失是人类AD患者认知障碍的最强相关性之一”
尽管阻断突触的小胶质细胞吞噬作用可以防止AD小鼠模型中的突触丢失,但触发这种不良吞噬过程的信号仍然是个谜。在这项发表在《自然神经科学》上并由博士后科学家Sebastiaan De Schepper博士领导的新研究中,研究小组揭示了小胶质细胞与邻近的血管周围巨噬细胞之间的前所未有的通信,巨噬细胞是一种排列小血管的细胞,发生在突触吞噬之前。
“我们发现了血管周围巨噬细胞在突触病理学中的惊人作用,”De Schepper博士解释说。“在正常大脑中,血管周围巨噬细胞在血液中巡逻潜在的病原体,但现在看来它们也对脉管系统周围淀粉样蛋白β的早期积累做出反应。
β淀粉样蛋白是一种存在于大脑神经元细胞中的蛋白质。当过多的这种蛋白质积累时,它会形成称为“斑块”的团块,这是AD的病理标志。
“然而,越来越清楚的是,淀粉样蛋白β在疾病早期积聚在血管周围,促使血管周围巨噬细胞等局部细胞启动免疫反应,”De Schepper博士补充说。
De Schepper博士和Hong博士在AD小鼠模型中使用最先进的显微镜技术,特别发现这种免疫反应需要释放SPP1或骨桥蛋白,这是一种充当免疫调节剂的糖蛋白,导致小胶质细胞吞噬突触的激活。
“值得注意的是,SPP1以前被发现在AD患者的脑脊液中高度表达,但直到现在功能未知,”De Schepper博士进一步解释说。“血管周围巨噬细胞释放SPP1可能代表新的治疗途径,以预测大脑免疫系统如何对AD的早期病理改变做出反应。
伦敦大学学院的Hong实验室进行的研究的一个过度目标是查明导致早期AD患者中观察到的突触丧失的小胶质细胞亚型。他们的新研究是朝着这个方向迈出的又一步,因为它帮助他们阐明了破坏小胶质细胞功能所涉及的一些过程。
“不同小胶质细胞和血管周围亚群的鉴定和表征将对AD突触的保存具有重要的治疗意义,”洪博士解释说。“我们假设一种潜在的亚型可以表征为促炎糖蛋白SPP1(骨桥蛋白)的高表达水平。在体内,SPP1标志着多个器官中的许多吞噬巨噬细胞亚型。在大脑中,SPP1还标记参与吞噬作用的小胶质细胞和血管周围巨噬细胞,包括突触。
De Schepper博士和他的同事随后使用单细胞RNA测序技术,这种方法使我们能够研究大脑单个细胞中活跃的基因。他们发现血管周围细胞通过SPP1主动指示小胶质细胞吞噬突触。下一步,他们使用遗传技术从小鼠身上去除SPP1基因。这使他们能够确定SPP1的缺失是否可以阻止小胶质细胞吞噬或吃掉重要突触的不良过程。
事实上,来自缺乏SPP1的小鼠的小胶质细胞(“Spp1-敲除小鼠”)被阻止吞噬突触,这表明该蛋白质是小胶质细胞吞噬发生所必需的。这组研究人员最近收集的结果证实了先前的发现,暗示了血管空间在AD中的核心作用。
“我们的研究结果支持早期的研究,这些研究强调大脑中的血管细胞是淀粉样蛋白 - β蛋白沉积物早期形成的关键部位,”Hong博士解释说。“这反过来可能引发SPP1的产生增加,这可能导致血管周围细胞向邻近的小胶质细胞发出信号,诱导与AD相关的突触暴饮暴食。
有趣的是,在他们的研究中,De Schepper博士及其团队还在已故AD患者海马体内的血管周围细胞中检测到SPP1,这意味着他们在小鼠身上的结果也适用于人类。因此,他们的发现可能很快为AD的新治疗干预措施的发展提供信息,这些干预措施旨在通过血管周围空间调节小胶质细胞活性。
“我们现在正在测试在AD早期阶段治疗靶向SPP1的不同方法,旨在防止大脑中的突触丢失和炎症,”De Schepper博士补充道。“一种方法是通过所谓的'反义寡核苷酸'(ASO)。ASO是小块遗传物质,旨在与体内的特定RNA分子结合。我们与制药公司Ionis一起开发了一种ASO,它特异性地与SPP1结合并干扰其产生,我们希望这将有助于将我们的发现转化为AD突触保存的新治疗方法。
