使用新的SNAPtag技术定制基于T细胞的免疫疗法
匹兹堡大学的研究人员开发了一种通用受体系统,使T细胞能够识别任何细胞表面靶标,从而实现高度可定制的CAR-T细胞和其他免疫疗法,用于治疗癌症和其他疾病。这一发现可能会扩展到实体瘤,并使更多的患者能够获得CAR T细胞疗法在某些血癌中产生的改变游戏规则的结果。
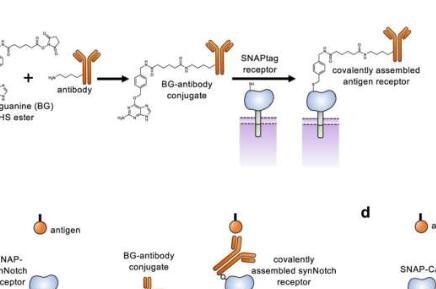
在今天发表的《自然通讯》研究中,新方法涉及用带有通用“SNAPtag”的受体改造T细胞,该受体与针对不同蛋白质的抗体融合。通过调整这些抗体的类型或剂量,可以针对最佳免疫反应量身定制治疗。
研究人员表明,他们的SNAP方法在两种重要的受体中起作用:CAR受体,一种协调一系列免疫反应的合成T细胞受体,以及SynNotch,一种可以编程激活几乎任何基因的合成受体。随着SNAP的加入,定制疗法的可能性几乎是无穷无尽的。
“我们首次证明我们可以制造一种通用的SynNotch受体。这个SNAP-SynNotch系统是超级可编程的,因为你可以同时有设计师输入和设计师基因输出,“资深作者Jason Lohmueller博士说,他是皮特医学院外科肿瘤学系外科和免疫学助理教授,也是UPMC希尔曼癌症中心的研究员。“我们希望我们可以使用这种方法进行细胞疗法,并为癌症,自身免疫性疾病,器官移植耐受性等提供基因。
CAR T细胞免疫疗法涉及对患者自身的细胞进行工程改造,以便T细胞受体在将癌细胞输回患者体内之前识别癌细胞上的特定蛋白质。
“CAR-T疗法的一个大问题是你只针对一种蛋白质,”Lohmueller解释说。“如果肿瘤进化为失去该蛋白质或下调它,你需要第二次重新设计T细胞,这是一个高度复杂且昂贵的过程。
为了克服这个问题,Lohmueller,第一作者Elisa Ruffo博士,Pitt博士后助理,Alexander Deiters博士,Pitt化学教授及其同事通过向CAR受体添加SNAPtag酶开发了通用SNAP-CAR T细胞。这些细胞与癌症靶向抗体一起给药,这些抗体用一种叫做苄基鸟嘌呤的分子标记。
通过生物正交化学(一种在生命系统中发生的反应,不会干扰自然过程),SNAPtag与苄基鸟嘌呤反应,将抗体融合到受体上。同时或一个接一个地添加不同的抗体,使受体能够识别不同的肿瘤特征。
“我们方法的独特之处在于T细胞如何与抗体相互作用。它不仅是结合,而且通过共价附着融合 - 最强的化学键形式,“Lohmueller解释说。“这种类型的生物正交方法已被证明在动物身上用于成像目的,但我们是第一批将其用于治疗的人之一,因此我们确实在推动共价技术的界限。
这种紧密结合的一个优点意味着可以用较低剂量的抗体实现受体的激活,Lohmueller说。使用数学建模,研究生Adam Butchy和Natasa Miskov-Zivanov博士,皮特斯旺森工程学院电气和计算机工程助理教授表明,也可能从抗体和肿瘤细胞之间的较弱相互作用中获得活性,为可以靶向的癌症蛋白质类型提供更大的灵活性。
共价键也是创建SNAP-SynNotch细胞的秘密成分。当SynNotch受体被激活时,机械拉力拉伸受体以暴露部分蛋白质,然后将其切割以释放转录因子,该转录因子传播到细胞核以打开所选基因的表达。
“我们发现我们需要共价键的强度来承受这种拉力,”Lohmueller解释说。“如果我们只是在受体和抗体之间结合,受体就会分开,我们不会得到信号传导。
研究人员表明,他们的通用SNAP-CAR和SNAP-SynNotch受体可以通过添加相应的抗体来响应不同的靶标被激活。SNAP-CAR T细胞还能够同时靶向不同类型细胞上的多种蛋白质,这表明它们可以帮助避免由于肿瘤靶点的变化或这些靶点的丧失而导致癌症复发。
在癌症小鼠模型中,用SNAP-CAR T细胞治疗缩小了肿瘤并大大延长了生存期,这是一个重要的概念验证,为与Coeptis Therapeutics合作在临床试验中测试这种方法奠定了基础,Coeptis Therapeutics已从Pitt获得SNAP-CAR技术许可。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
安徽淮南地区的长安汽车经销商近期对2025款启源Q05车型的市场策略进行了调整,以进一步吸引消费者。作为长安汽...浏览全文>>
-
近年来,豪华SUV市场持续升温,而作为大众旗下的高端品牌,途锐凭借其卓越的性能与豪华配置,一直深受消费者的...浏览全文>>
-
在新能源汽车市场中,一汽-大众ID 4 CROZZ凭借其出色的性价比和丰富的配置吸引了众多消费者的关注。作为一款...浏览全文>>
-
近年来,随着国内汽车市场的快速发展,越来越多的消费者开始关注性价比高的小型车。QQ多米作为一款备受关注的...浏览全文>>
-
在当今的汽车市场中,选择一款高性价比的车型是许多消费者的重要考量。对于追求品质与经济平衡的购车者来说,...浏览全文>>
-
阜阳地区消费者对上汽大众途岳的关注度一直很高,尤其是2025款途岳的上市更是引发了广泛关注。作为一款紧凑型S...浏览全文>>
-
天津滨海长安猎手K50作为一款备受关注的车型,在市场上拥有较高的关注度。这款车型以其出色的性能和合理的价格...浏览全文>>
-
近年来,随着新能源汽车的普及,插电混动车型因其兼顾燃油经济性和驾驶性能的特点,受到了越来越多消费者的青...浏览全文>>
-
途观X作为上汽大众旗下的高端轿跑SUV车型,凭借其时尚动感的外观设计和丰富的科技配置,在市场上一直备受关注...浏览全文>>
-
在选择SUV车型时,上汽大众途昂凭借其宽敞的空间和强大的性能成为不少消费者的首选。对于蚌埠地区的消费者来说...浏览全文>>
- 天津滨海长安猎手K50多少钱 2025款落地价,最低售价18.29万起,赶紧行动
- 天津滨海ID.4 CROZZ 2025新款价格,买车省钱秘籍
- 安徽淮南途昂X多少钱?性价比超高的选车秘籍
- 福特领睿试驾,开启完美驾驭之旅
- 比亚迪海豹05DM-i试驾预约流程
- 凯迪拉克CT5预约试驾,从预约到试驾的完美旅程
- 滁州途观X落地价,各配置车型售价全知晓
- 极狐 阿尔法T6试驾,开启完美驾驭之旅
- 长安欧尚520试驾操作指南
- QQ多米试驾需要注意什么
- 长安Lumin试驾,感受豪华与科技的完美融合
- 安庆长安猎手K50最新价格2025款与配置的完美平衡
- 池州迈腾GTE最新价格2022款全解,买车必看的省钱秘籍
- 安徽亳州ID.6 X多少钱?购车全攻略来袭
- 五菱雪宝试驾,开启豪华驾驶之旅
- 马自达EZ-6预约试驾,新手必看的详细流程
- 安徽亳州T-ROC探歌落地价实惠,配置丰富,不容错过
- 滁州高尔夫GTI价格大揭秘,买车前必看
- 东莞威然落地价,最低售价22.99万起优惠不等人
- 试驾王牌M7,体验豪华驾乘的乐趣
